文章来源:健康时报 2022-09-26 14:07
首款国产新冠口服药花落真实生物。争议声缘何大于期望值?
7月25日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。此次为附条件批准新增适应症,用于治疗普通型新型冠状病毒肺炎(COVID-19)成年患者。患者应在医师指导下严格按说明书用药。
此新闻一出,引得热议纷纷。笔者就热议最多的内容,浅做分享。
热论1:数据“粗略”,缘何获批?
截至目前,真实生物就阿兹夫定的3期临床数据披露仍然相当“粗略”,其具体的临床方案、临床重点设置、入组人数与标准、剂量用法、相关结果的具体指标等至今都未有详细明确的数据公布。

图片来源:真实生物官微
尽管当前披露的数据非常有限,但还是有几点值得聊聊:
1)针对何种新冠毒株?在真实生物目前官方披露的数据中,并没有说明是针对何种新冠变异毒株的,对目前大流行的奥密克戎是否仍然能够有效?其降低病毒载量的能力如何?具体Ⅲ期临床中共有多少例受试者,哪些方面的症状改善更为显著?
2)何为“中度新型冠状病毒患者”?据最新版《新型冠状病毒肺炎诊疗方案(试行第九版)》,在新冠患者临床分型中,有轻型、普通型、重型、危重型这四种,并没有“中度”一说。据官方信息披露,真实生物也并未解释“中度新冠患者”的入组标准和具体适用人群。
3)“症状改善”如何定义?从阿兹夫定地Ⅲ期临床试验设计来看,主要终点是用药一个月内住院人数。而官方的新闻披露则是第7天的症状改善比例,让人不禁质疑这一试验结果在试验设计里是属于主要终点吗?
4)抑制新冠的有效性,即5天左右清除病毒、7天后明显改善临床症状,相较于不服用任何药物,确实“缩短了(康复)时间”。
5)患者招募标准是什么?据新闻稿数据显示,阿兹夫定的临床试验计划招募312人,招募标准里并未提及疫苗接种人数、比例、用药组与安慰剂组疫苗接种情况等等。
众所周知,药物的公开数据需详尽与透明,因为评判药物是否有效并不是依赖药企的新闻稿,而是科学详细的临床数据,这样才能让人们真实、客观判断一个药物的有效性、安全性。阿兹夫定作为目前获批首个国产上市新冠抗病毒药,数据披露更应明确,对于后来者可以借鉴参考,让参与研发的企业和团队能更合理的设计试验,不做无用功。
热论2:疗效、安全性备受争议
围绕着阿兹夫定的疑问并不会随着该药物获批上市而就此画上句号。民生证券分析师周超泽曾表述,新冠口服药的核心竞争点在疗效、成本、安全性等三大因素,第一竞争点还是疗效。
这一点,海外市场已经证明。
作为全球首个获批的小分子口服药,默沙东的Molnupiravir在上市之初的确卖到脱销。默沙东一季度报显示,Molnupiravir一季度收入32亿美元,是Paxlovid销售额的两倍多。
此前,默沙东预计Molnupiravir全年收入50到55亿美元。如今仅一季度销售收入,就达到了全年预期的64%。
不过,事情正在发生逆转。自5月以来辉瑞Paxlovid的销售正在激增,而Molnupiravir的销售额则开始下降。原因无他,Molnupiravir疗效不及Paxlovid。
回到国内来看,国产新冠口服药玩家众多。包括先声药业的SIM0417、君实生物/旺山旺水的VV116、开拓药业的普克鲁胺、科兴制药的SHEN26、众生药业的RAY1216等10余款,涉及3CL蛋白酶、RNA聚合酶等多种技术路线。
阿兹夫定尽管在国产新冠口服药行列占据了先发优势,但能否保持持续领先,目前暂无定论。
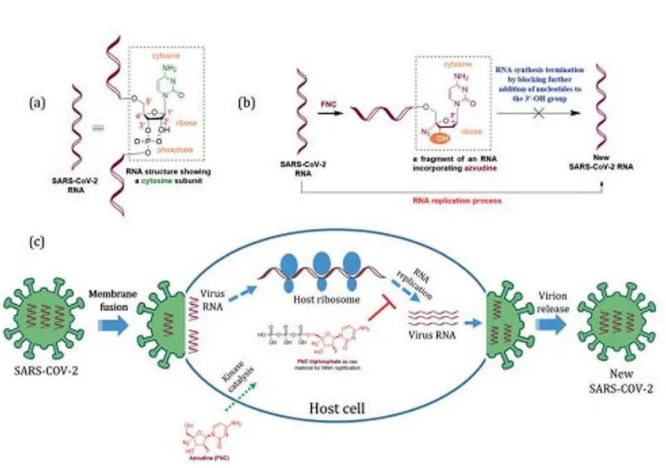
阿兹夫定是一种核苷类抗病毒药物,由郑州大学团队研制,在2021年7月20日,国家药监局批准其上市用于治疗高病毒载量的成年HIV-1感染患者。2020年2月,研究人员发现,阿兹夫定也可能对新冠病毒有效,2020年4月,该药物作为潜在的新冠特效药被批准进行3期临床试验。
艾滋病治疗新药阿兹夫定,又为何能够治疗新冠?
目前关于阿兹夫定的数据文献并不多,基本上是由真实生物团队发表的。相关研究表明,阿兹夫定是一种通过阻断病毒RNA复制来抑制新冠病毒的RdRp(RNA依赖性RNA聚合酶)抑制剂。而新冠病毒,和HIV一样是典型的RNA病毒,即阿兹夫定的原理是通过阻断病毒RNA复制和抑制新冠病毒的活性,来达到治疗新冠的效果。
但阿兹夫定的作用机制也有不少地方值得商榷。它是一款针对HIV研发的核苷类逆转录酶抑制剂。但这类药物有很多,实际上并没有多少显示对新冠有效。
阿兹夫定化学结构和比拉米夫定类似,之前也只在HIV感染者中做过与比拉米夫定的非劣性2期临床试验。由于HIV的鸡尾酒治疗是三药复方,试验中阿兹夫定与比拉米夫定都是与另外两个HIV药物联用。阿兹夫定在该试验里用了2、3、4mg组。现在治疗新冠用了5mg。可问题是阿兹夫定抑制新冠病毒与抑制HIV病毒的效率可比吗?
2020年10月,阿兹夫定发现者常俊标在《SignalTransductionandTargetedTherapy(信号传导与靶向治疗)》发表了标题为《Azvudine(FNC):apromisingclinicalcandidateforCOVID-19treatment(阿兹夫定(FNC):一种有前途的COVID-19治疗临床候选药物)》的论文,介绍了这项研究的结果。
图片来源:《Azvudine(FNC):apromisingclinicalcandidateforCOVID-19treatment(阿兹夫定(FNC):一种有前途的COVID-19治疗临床候选药物)》
该研究的初步临床试验的结果较为理想:在实验组10例患者当中,4天内第一次核酸转阴率达到90%,相较而言,常规治疗组4天内第一次核酸转阴率仅仅10%。更值得一提的是,实验组中有一位患者入院治疗了20多天,采用很多方案核酸检测均未转阴,而在服用了阿兹夫定药物后的第五天,核酸检测就转为了阴性。
但论文中也提及,阿兹夫定主要在胸腺处累积,但新冠感染早期或轻症患者,其病毒主要位置不在胸腺而在呼吸系统。依此证据作为阿兹夫定对新冠有效的理由之一,实在令人不解。
从发病机制来看,新冠轻症患者发病在于病毒体内大量复制,而重症患者则更多在于人体免疫系统过度激活。因此,当前新冠治疗药物目前研发派系泾渭分明,抗病毒药物的临床设计集中在轻症患者,各种免疫调节药物的临床设计则多集中在重症患者。
但当前阿兹夫定的临床试验设计在新冠轻症重症患者中都在进行,且均数据显示有效。不得不说,一个药自称万事皆可,未必能成一事。在有限的研究中却展现了惊人的多种疾病普适性,还是谨慎些更妥当。
热论3:“一女多嫁”,复星医药豪掷8亿元拿下独占权
在阿兹夫定获批的当天晚间,复星医药便公告称,控股子公司复星医药产业与真实生物签订《战略合作协议》,就推进双方联合开发并由复星医药产业独家商业化阿兹夫定等事宜达成战略合作,合作适应症中就包括了新冠肺炎,合作区域则包括中国境内(不包括港澳台地区)以及部分海外市场。
这也意味着,复星医药抢到了首款国产新冠特效药在中国境内等地区的独家商业化权。
值得一提的是,从去年以来,复星医药就频繁在发力新冠药物业务。如去年7月份,复星医药就与开拓药业就普克鲁胺治疗新冠在印度和28个非洲国家的商业化达成合作协议,共同推进普克鲁胺新冠适应症的紧急使用授权(EUA)申请、推广和销售工作。紧接着,今年以来,复星医药与药品专利池组织(MPP)签订了协议,即在一些中低收入国家可以仿制两款新冠口服药,分别是默沙东的Molnupiravir以及辉瑞的Paxlovid。
因此,在纳入阿兹夫定后,复星医药已“坐拥”三款新冠特效药,系全球唯一一家。
有意思的是,在上述两家公司宣布合作之前,今年4月和5月,阿兹夫定专利方真实生物分别与新华制药与华润双鹤签署协议。其中“新华制药为其拥有的阿兹夫定等产品在中国及经双方同意的其他国家的产品生产商和经销商”,而华润双鹤和真实生物也在“产品研发、生产、经销以及与经销直接相关的多个方面、领域拓展合作”。
值得一提的是,新华制药在6月2日公告中曾提醒,双方只是达成初步战略性合作协议,尚未签署任何相关产品的具体合作协议,并且该战略合作协议并无排他性,新华制药并非真实生物的唯一合作方。
从此次复星医药的大手笔支出来看,合作十分有诚意。
据公告显示,此次双方合作领域包括新冠病毒、艾滋病治疗及预防领域,但合作区域尚未最终确定。拟合作区域有两个,区域1是中国境内,不包括港澳台地区;区域2是区域1以外的全球地区,但不包括俄罗斯、乌克兰、巴西及其他南美洲国家和地区。
作为开展尽调及后续合作的前提条件,复星医药需在协议签署生效后的5个工作日内向真实生物支付1亿元,除非真实生物故意违约导致协议终止,该款项不退。
就中国境内之合作,复星医药应在真实生物依约提供完整尽调资料并开放合作产品生产现场后的10个工作日内,完成尽调和评估。如符合预期,则再在7个工作日内向真实生物支付3.995亿元,用于合作产品临床前研究和工艺、生产、质量等方面的投入。
而在尚未获批的区域2之合作,如尽调和评估结果合适,双方将签订补充协议,复星医药将再付3亿元。
另外,据复星医药公告显示,由于阿兹夫定是应急附条件批准上市,药监局需要真实生物“继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果”。后续临床试验的开展以及费用承担,都由复星医药完成。
至于利润分成,合作产品在中国境内销售产生的毛利,根据销售渠道的不同,由复星医药和真实生物按照50%:50%或55%:45%的比例进行分配。
截至目前,复星医药公告披露,阿兹夫定的定价尚未完成。据首创证券披露,目前已上市的阿兹夫定作为艾滋病药物售价是25.86元/mg,按新冠治疗每个疗程35mg计算,目前价格对应治疗费用约为900元/疗程。若国家层面的大量采购将会较大幅度降低价格,假设初期作为战略储备采购量为1000万份,单个疗程价格为300元,对应市场空间为30亿元。